
La unidad de citometría de flujo de la RAI ofrece a la comunidad científica una amplia gama de servicios basados en la citometría de flujo multiparamétrica tanto para análisis como para separación celular. Esta unidad ofrece el empleo de los citómetros disponibles por usuarios registrados (autoservicio) y la adquisición de muestras por el equipo técnico de la unidad.
La citometría de flujo multiparamétrica es una técnica por medio de la cual es posible analizar características estructurales y funcionales de células o partículas en suspensión que atraviesan una fuente de luz (láser). Esta metodología tiene múltiples aplicaciones, tanto en el área clínica, como en los campos de la investigación biomédica y de biología celular.
Esta herramienta de análisis permite cuantificar simultáneamente diversos parámetros (morfológicos, fenotípicos, bioquímicos) de células a nivel individual y de manera expedita (miles de células/segundo), lo cual la convierte en una metodología de gran validez y aplicabilidad.
Las células presentes en la suspensión celular habitualmente son teñidas con anticuerpos conjugados a diversos fluoróforos (por ejemplo FITC, PE Cy5, APC, entre otros) ya sea para marcar moléculas de superficie o intracitoplásmicas que permitan realizar inmunofenotipificación o análisis de diversos procesos celulares.
Principales Aplicaciones
- Detección de subpoblaciones celulares (inmunofenotipo)
- Análisis de ciclo celular y ensayos de proliferación celular
- Apoptosis y viabilidad
- Señalización intracelular
- Metabolismo oxidativo
- Detección de fosfoproteínas a nivel unicelular
- Ensayos multiplexados (Beads arrays)
- Aislamiento de diversas subpoblaciones celulares (cell sorting)
Fundamentos
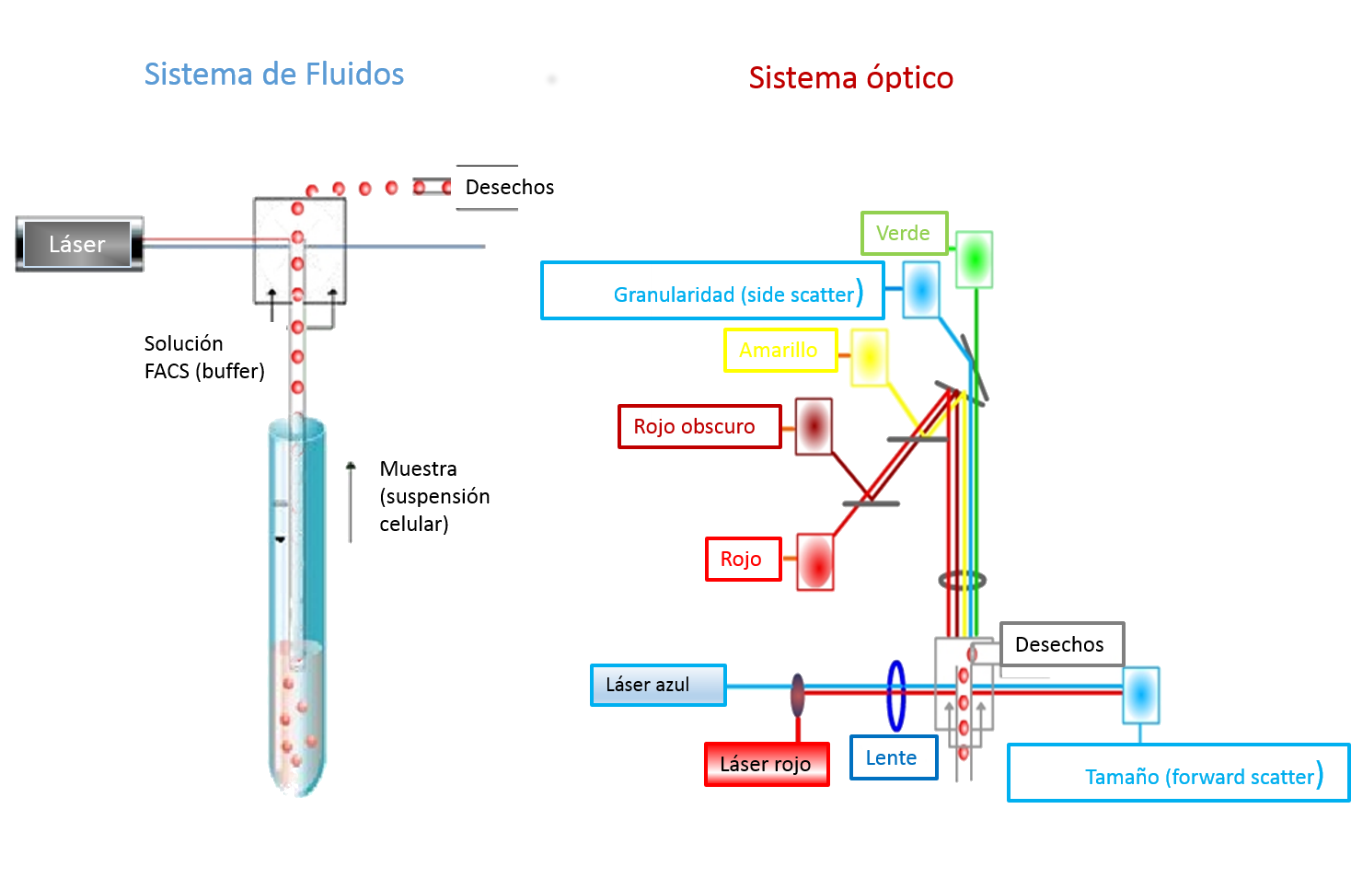
Un citómetro de flujo se basa en tres principales sistemas
1. Sistema óptico
Este sistema está constituido por los siguientes elementos: a) láser, b) filtros y c) lentes.
La fuente de luz es producida por uno o varios láser. La mayoría cuenta con un láser de gas argón refrigerado por aire o láser en estado sólido, los cuales producen una luz monocromática de 488 nm como láser principal. Esta luz se emplea para la excitación de la mayoría de los fluorocromos y provoca la dispersión de luz que es una medida indirecta de las características de la suspensión celular o de las partículas evaluadas. La luz dispersada y la fluorescencia emitida es recogida por un sistema de filtros y lentes que dirigen las señales a los sensores de detección (fotodiodo/fotomultiplicadores).
2. Sistema hidráulico
Está conformado por un conjunto de controladores neumáticos y fluídicos necesarios para poder lograr un flujo laminar que permita a la suspensión celular atravesar la cámara de flujo de forma estable e individualizada.
3. Sistema electrónico
Los fotomultiplicadores convierten la luz dispersa (fotones) en señales eléctricas (voltaje). Estas señales analógicas son amplificadas y convertidas para su digitalización y posterior visualización en el computadora.
La integración de estos sistemas permite un análisis rápido y preciso de una gran cantidad de células en poco tiempo.
Equipos
Características principales de los equipos disponibles:
| Equipo | Análisis multiparamétrico (MP) | Selección celular (sorting) | Máx. células / seg | Láser (excitación en nm) |
|---|---|---|---|---|
| Accuri C6 | Sí | No | 488/640 | |
| LSR II | Sí | No | 25,000 | 488/640/405/355 |
| Aria III | Sí | Sí | 25,000 | 488/635/405 |
| Manual de procedimientos del Accuri C6
Manual del usuario Guía rápida de uso |
BD Accuri C6 |
Configuración BD Accuri C6
No. Parámetros: 6
No. Colores: 4
2 Láseres 4 colores
3-Blue / 1-Red (3-1)
Fecha de configuración: enero-2015
Configuración estándar
| Láser | Canal | Filtro | Fluorocromo |
|---|---|---|---|
| Blue (480 nm) | FL - 1 | 530/30 | FITC / BB515 / AF488 / CFSE / GFP |
| FL - 2 | 585/40 | PE / PI / PE-CF594 | |
| FL - 3 | 670 LP | PerCP / PE-Cy5 / PerCP-Cy5.5 / PE-Cy7 / 7-AAD | |
| Red (640 nm) | FL - 4 | 675/25 | APC / AF647 |
| Manual de procedimientos del Fortessa LSRII
Manual del usuario Guía rápida de uso |
BD LSRII Fortessa |
Configuración BD LSRII Fortessa 4 lásers 16 colores (2-6-5-3)
| BP | DM LP | Detector | ||
|---|---|---|---|---|
| UV 355 nm | A | 530/30LP | 505LP | BUV496 |
| B | 450/50 | AF350/DAPI/Indo-1 | ||
| C | ||||
| Violet 405 nm | A | 780/60 | 750LP | BV786 |
| B | 710/50 | 690LP | BV711 | |
| C | 660/20 | 630LP | BV650 | |
| D | 610/20 | 595LP | BV605 | |
| E | 525/50 | 475LP | BV510/V500 | |
| F | 450/50 | BV421/V450 | ||
| G | ||||
| Blue 488 | A | 780/60 | 750LP | PECy7 |
| B | 695/40 | 685LP | PE-Cy5/PerCP/PerCPCy5.5 | |
| C | 610/20 | 600LP | PECF594 | |
| D | 575/26 | 550LP | PE/PI | |
| E | 530/30 | 505LP | AF488/BB515/CFSE/FITC/GFP | |
| F | 488/10 | SSC | ||
| Red 640 nm | A | 780/60 | 750LP | APCH7/APCCy7 |
| B | 730/45 | 710LP | AF700 | |
| C | 670/14 | APC/AF647 |
| Manual de procedimientos del Aria III Sorter
Manual de usuario |
Aria III Sorter |
Configuración Aria III Sorter
No. Parámetros: 11
No. Colores: 9
3 Láseres 9 colores FSC 1.5, 70 um, 488 - 633 - 405
Fecha de la configuración: 07-Julio-2016
Sheat Pressure: 70 psi
Nozzle size: 70 um
Windows Extension: 2.00 us
| Láser | Detector | Filter | Mirror LP | Fluorocromo |
|---|---|---|---|---|
| Blue (488 nm) | A | 780/60 | 735 | PE-Cy7 |
| B | 695/40 | 655 | PE-Cy5 / PerCP / PerCP-Cy5.5 | |
| C | 616/23 | 610 | PE-CF594 | |
| D | 585/42 | 556 | PE / PI | |
| E | 530/30 | 502 | AF488 / BB515 / FITC / GFP / CFSE | |
| F | 488/10 | - | SSC | |
| G | - | - | - | |
| H | - | - | - | |
| Red (633 nm) | A | 780/60 | 755 | APC-Cy7 / APC-H7 |
| B | 660/20 | - | APC | |
| C | - | - | - | |
| Violet | A | 510/50 | 502 | BV510 / V500 |
| B | 450/40 | - | BV421 / V450 | |
| C | - | - | - | |
| D | - | - | - | |
| E | - | - | - | |
| F | - | - | - | |
| G | - | - | - | |
| H | - | - | - |
Para el servicio de separación de células contamos con Nozzle de 70, 85 y 100 μ
Contacto
Para mayor información o asesoría sobre los servicios favor de contactar a:
-
Dra. Diana Gómez Martín
Investigadora Responsable
- d_gomarhotmail.com
-
Dr. Guillermo Juárez Vega
Técnico Académico
- guillermovegacic.unam.mx
- +01 (55) 5487 0900 Ext. 6330 ó 6331
