
La Unidad de Microscopía en el Instituto Nacional de Cancerología provee a la comunidad científica una amplia gama de servicios que facilitan la investigación. Ofrecemos soluciones flexibles para una gran variedad de aplicaciones, tales como las que se enlistan a continuación:
- Inmunoflorescencia
- Inmunohistoquímica (campo claro)
- Contraste de fase
- Marcaje fluorescente mediante transfección de proteínas quiméricas fluorescentes o FISH
- Microscopía de células vivas sin marcaje
- Sistema automatizado de detección y captura de imagen de células en mitosis y de cromosomas mitóticos que han sufrido translocaciones específicas
- Microscopio estereoscópico
- Sistema de microdisección láser y brazo robótico para captura de muestras microdisectadas
- Inmunofluorescencia en líneas celulares o cortes histológicos de hasta 2 mm de espesor
- Microscopía diseñada para trabajo de alto volumen
- Microscopio electrónico de barrido emisión de campo AURIGA
Fundamentos de la microscopía
La Microscopía es una herramienta que nos permite magnificar objetos mediante el uso de luz, electrones, rayos X, ondas de sonido, etc, para producir imágenes que pueden ser usadas para análisis científico. Hay muchos tipos de microscopía y abordaremos las mas comunes, empezando por la mas usada y conocida desde antaño: la microscopía óptica.
1. Microscopía Óptica
La microscopía óptica o fotónica involucra el paso de la luz visible, ya sea de forma transmitida o reflejada a través o desde la muestra, respectivamente, por una serie de lentes para poder magnificarla y posteriormente obtener la imagen directamente a través de los ojos o través de una cámara digital como ejemplo. Precisamente, el sistema de lentes, el sistema para hacer imágenes, el sistema de iluminación, el soporte del equipo y el de la muestra, es lo que compone en esencia un microscopio óptico.
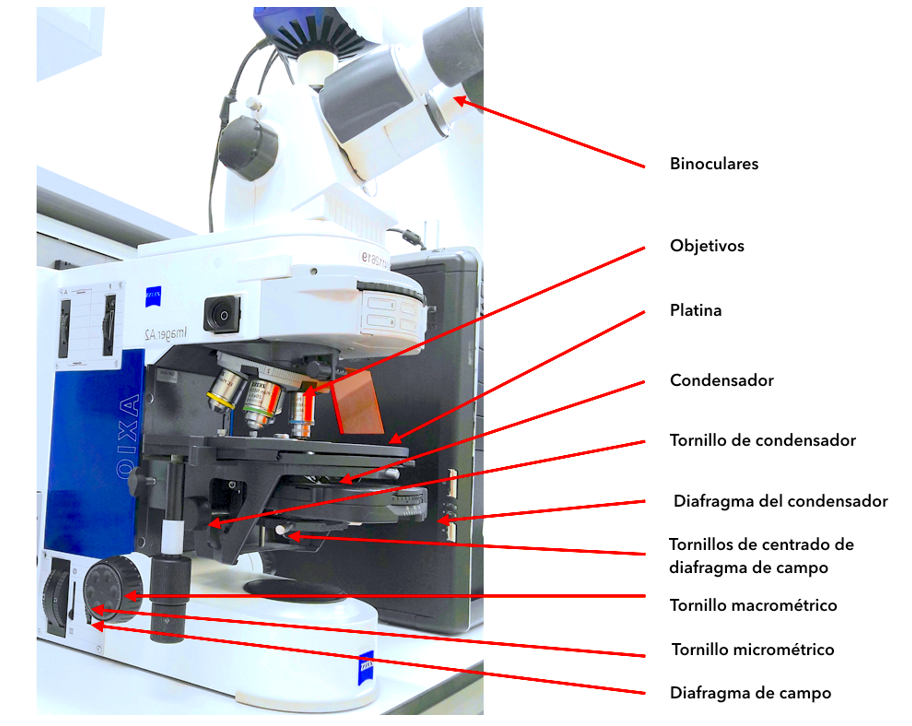
1.1 Técnicas de microscopía óptica
Hay distintas técnicas para aumentar el contraste de la muestra:
La iluminación de la muestra es vía luz transmitida a través de ella. Su limitante es que hay poco contraste en la mayoría las muestras biológicas y es por ello que deben teñirse con algún colorante orgánico para poder observarlas. Otra limitante es que hay poca nitidez debido a la luz fuera de foco.
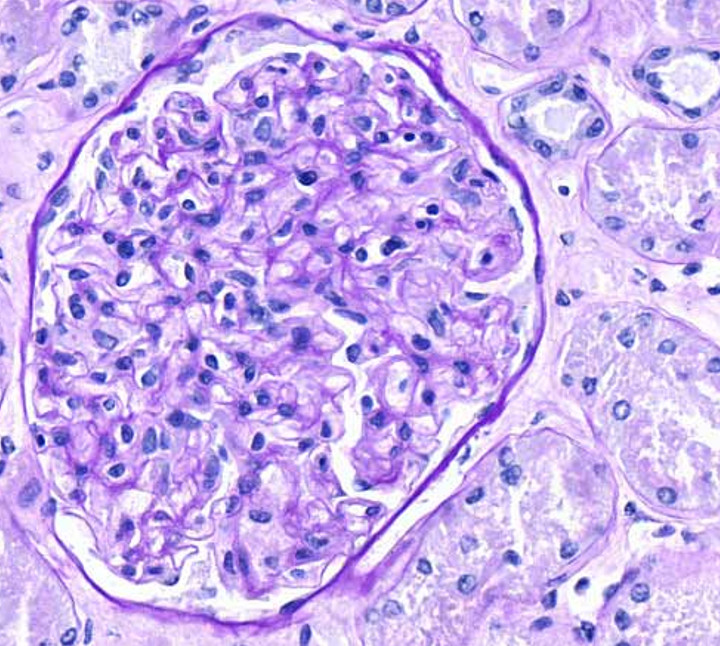 Glomérulo teñido en una sección de 4 µm de un tejido de riñón. Imagen obtenida del AxioScan (Carl Zeiss) del departamento de Patología de la Universidad de Pittsburgh, USA.
Glomérulo teñido en una sección de 4 µm de un tejido de riñón. Imagen obtenida del AxioScan (Carl Zeiss) del departamento de Patología de la Universidad de Pittsburgh, USA.
Esta técnica mejora el contraste de las muestras que son transparentes y que no tienen tinción. La fuente de iluminación tiene un alineamiento tal que se minimiza la cantidad de luz transmitida que entra directamente al plano de la imagen y solo se colecta la luz dispersada por la muestra.
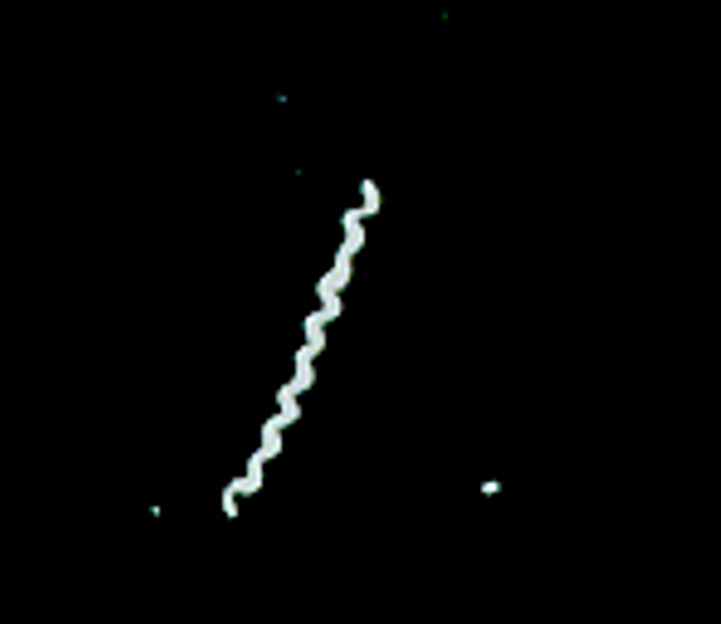 Treponema Pallidum de un exudado de una ulcera en pene de un paciente con sífilis. Cortesía de Charles B. Hicks, M.D.
Treponema Pallidum de un exudado de una ulcera en pene de un paciente con sífilis. Cortesía de Charles B. Hicks, M.D.
Esta técnica explota los cambios en el índice de refracción para producir imágenes de alto contraste en especímenes transparentes; permite observar células sin colorear y resulta especialmente útil para células vivas. La mayoría de los organismos vivos no pueden ser teñidos debido a que los colorantes utilizados pueden dañar su estructura celular hasta el punto de su muerte. Esta técnica de microscopía aprovecha las pequeñas diferencias de los índices de refracción en las distintas partes de una célula y en distintas partes de una muestra de tejido. La luz que pasa por regiones de mayor índice de refracción experimenta una deflexión y queda fuera de fase con respecto al haz principal de ondas de luz que pasaron la muestra. Posteriormente, las otras longitudes de onda que quedan fuera de fase son apareadas por medio de una serie de anillos ubicados en el condensador y en el objetivo. Esto anula la amplitud de la porción fuera de fase inicial del haz de luz y produce un contraste útil sobre la imagen. Las partes oscuras de la imagen corresponden a las porciones densas del espécimen; las partes claras de la imagen corresponden a porciones menos densas. Por lo tanto estos microscopios se utilizan para observar células vivas, tejidos vivos y cortes semifinos no coloreados.
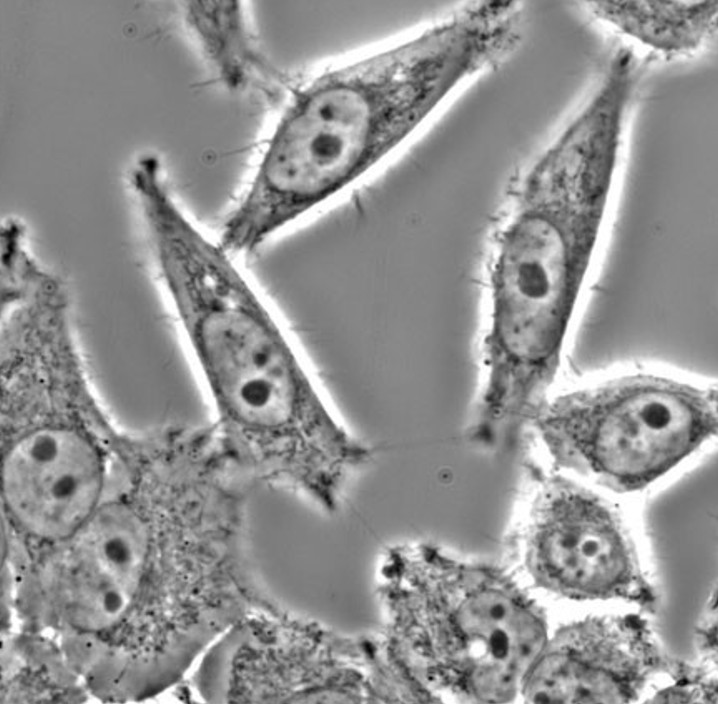 Imagen de células HeLa obtenidas en un microscopio de contraste de fases.
Imagen de células HeLa obtenidas en un microscopio de contraste de fases.
Contraste de interferencia diferencial (DIC)
En esta técnica las diferencias en densidad óptica se muestran como diferencias en el relieve. De este modo, un núcleo dentro de una célula se ve como una estructura globular. Sin embargo, esto es solo un efecto óptico y el relieve no refleja necesariamente la verdadera morfología. El sistema consiste de prismas especiales (prismas de Nomarski) en el condensador que dividen la luz en un rato ordinario y otro extraordinario. La diferencia espacial entre ambos rayos es mínima (menor que la resolución máxima del objetivo). Después de pasara través del espécimen, los rayos se reúnen por un prisma similar en el objetivo. En una muestra homogénea, no hay diferencia entre los dos rayos Y por tanto no se genera contraste. Sin embargo, cerca de una frontera o delimitación, que causa refracción, digamos el núcleo dentro del citoplasma, la diferencia entre los rayos ordinario y extraordinario generarán un relieve en la imagen. La técnica DIC requiere una fuente de iluminación polarizada y dos filtros polarizadores, uno debajo del condensador (polarizador) y el otro sobre el objetivo (analizador).
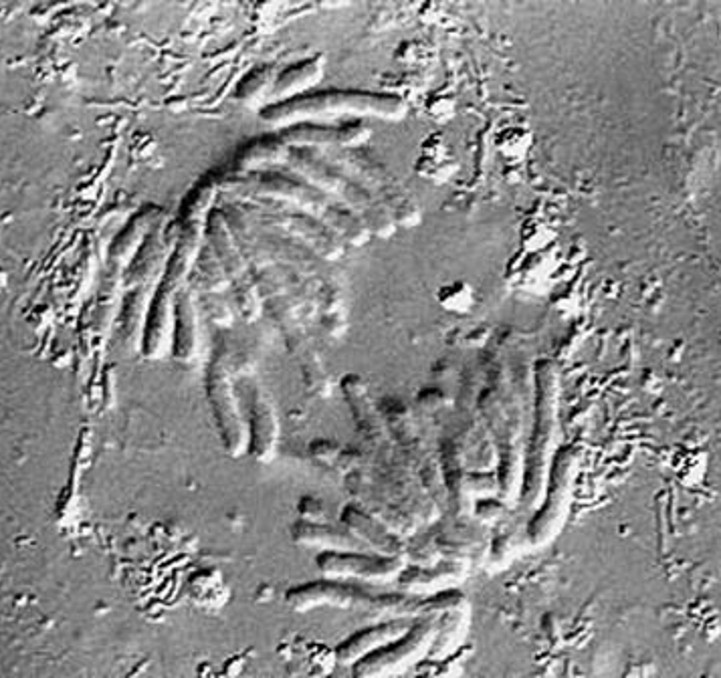 Imagen de célula mitótica en división, obtenida en microscopio invertido con primas Nomarski para realizar DIC.
Imagen de célula mitótica en división, obtenida en microscopio invertido con primas Nomarski para realizar DIC.
Esta técnica es muy importante en las ciencias biológicas modernas, ya que puede ser muy sensible, lo que permite la detección de moléculas únicas. Muchas moléculas fluorescentes pueden ser usadas para teñir diferentes estructuras en una célula. Un ejemplo de esta técnica, es el uso de anticuerpos acoplados a estas moléculas fluorescentes para hacer inmunofluorescencia.
Dado que la emisión de la fluorescencia difiere en longitud de onda de la luz de excitación, la imagen fluorescente muestra solo la estructura de interés que fue marcada con la molécula fluorescente. Esta especificidad ha permitido el uso amplio y popular de la microscopía de fluorescencia en la investigación biomédica. Diferentes fluoróforos pueden ser usados para teñir diferentes estructuras biológicas que después pueden ser detectadas simultáneamente en el microscopio.
Para bloquear la luz de excitación y que ésta no alcance al observador o al detector se requiere de un sistema de filtros especializado. Este sistema consiste de un filtro de excitación que va a seleccionar el rango de longitud de onda que nos interesa para excitar a la molécula fluorescente específica, un espejo dicroico y un filtro de emisión que bloqueará la luz de excitación. La mayoría de los microscopios de fluorescencia operan en el modo de epi-iluminacion, es decir que l iluminación y la detección se realizan de solo un lado de la muestra (del lado que da frente al objetivo).
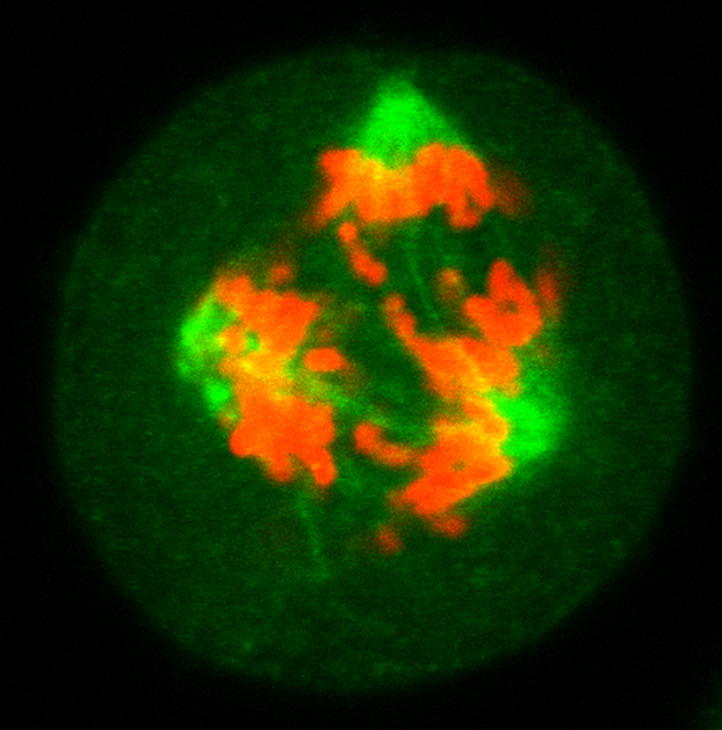 Células HeLa tripolar. La fluorescencia del huso es resultado de la expresión de la proteína GFP fusionado a la Beta-Tubulina. Los cromosomas están marcados con DAPI.
Células HeLa tripolar. La fluorescencia del huso es resultado de la expresión de la proteína GFP fusionado a la Beta-Tubulina. Los cromosomas están marcados con DAPI.
Referencias:
Zernike, F., Phase-contrast, a new method for microscopic observation of transparent objects. Part I.., Physica: 9, 686-698 (1942).
Microscope Basics and Beyond. Revised edition 2003. Mortimer Abramowitz. Olympus America
Before you touch that microscope, 2014. Martin wilson. Science Squared Ltd, UK.
Equipos
AxioImager A2Microscopio vertical equipado con lámpara para epifluorescencia X-Cite y cámara digital monocromática AxioCam HRm. |
 |
Axioskop2 Mot PlusMicroscopio vertical con movimiento motorizado en Z |
 |
Stereo Discovery V12Microscopio estereoscópico, equipado con revolver de objetivos Plan S 1.0X FWD 81mm, PlanApo S 1.5X FWD 30 mm y Plan Apo S 0.63X FWD 81 mm. |
 |
LightSheet Z.1Microscopio con carrusel de filtros y objetivos de alta resolución, motorizados, dos cámaras digitales de alta resolución y una fuente de iluminación basada en 4 líneas de láser. |
 |
Contacto
Para mayor información o asesoría sobre los microscopios favor de contactar a:
-
Dr. Alejandro López Saavedra
Investigador Responsable
- Instituto Nacional de Cancerología
- Laboratorio de Carcinogénesis
- alexadmiramicro.com
- +52(55) 5628 0400 Ext. 20011
- Unidad de Aplicaciones Avanzadas en Microscopía
- Sitio web ADMiRA: admiramicro.com







