
La Unidad de Metabolómica y Proteómica de la RAI provee a la comunidad científica de una amplia gama de servicios que facilitan la investigación con un abordaje funcional. Los servicios ofrecidos incluyen técnicas cromatográficas y de determinación de interacciones moleculares mediante el Biacore.
Los servicios consisten en la separación e identificación selectiva de componentes químicos y/o biológicos de una mezcla compleja, que por otras técnicas en muchas de las ocasiones resulta imposible. Además, es posible cuantificar de forma muy precisa la pureza y concentración de los diversos analitos encontrados en estas mezclas.
Las herramientas analíticas ofrecidas en el Laboratorio de Cromatografía son cromatografía líquida de alta eficiencia con arreglo de diodos (HPLC, por sus siglas en inglés) y cromatografía de gases acoplado a un espectrómetro de masas (CG).
Respecto a la cromatografía líquida, la cromatografía de gases tiene la ventaja de disponer de detectores mucho más universales (por ejemplo, el de ionización de llama). Además, para numerosas aplicaciones, los métodos son más simples, más rápidos y más sensibles que los correspondientes a la cromatografía líquida de alta resolución. La instrumentación requerida para cromatografía de gases también es mucho más sencilla y económica que la empleada en HPLC. Sin embargo, en cromatografía de gases, la influencia de la temperatura sobre la distribución del equilibrio es considerable, a diferencia de la cromatografía líquida.
Por esta razón, la cromatografía de gases se emplea cuando los componentes de la mezcla problema son volátiles o semivolátiles y térmicamente estables a temperaturas de hasta 350-400ºC. En cambio, cuando los compuestos a analizar son poco volátiles y/o termolábiles, la técnica separativa adecuada suele ser HPLC.
Las herramientas proteómicas y metabolómicas que el laboratorio ofrece pueden ser vistas como una aproximación para explicar la información contenida en secuencias genómicas en términos de la estructura, función y control de los procesos biológicos y vías de señalización. El laboratorio de la proteómica está interesado en la comprensión de los procesos biológicos a partir del análisis sistemático de proteínas expresadas en una célula o tejido, siendo actualmente la espectrometría de masas una de las herramientas más importantes en la proteómica.
En el caso del equipo Biacore, los estudios que pueden llevarse a cabo sirven para determinar la especificidad entre dos o más compuestos y/o para caracterizar la cinética y afinidad de dicha interacción. Con el análisis de los datos se obtienen las constantes de velocidad así como de asociación/disociación del complejo formado. Asimismo, también se emplea para estudiar interacciones a diferentes temperaturas, muy útil por ejemplo en la caracterización de mutantes proteicos. Entre sus principales ventajas se encuentra su gran sensibilidad, fundamental en el caso de interacciones fármaco-blanco molecular.
Fundamentos
Cromatografía Líquida de Alta Eficiencia y Cromatografía de Gases
Resonancia del plasmón de superficie - BIACORE
Cromatografía Líquida de Alta Eficiencia (HPLC) y Cromatografía de Gases (CG)
En general, una cromatografía se realiza permitiendo que la mezcla de moléculas que se desea separar (muestra) interaccione con un medio o matriz de soporte que se denomina fase estacionaria. Un segundo medio (la fase móvil) que es inmiscible con la fase estacionaria se hace fluir a través de ésta para "lavar" (eluir) a las moléculas en la muestra.
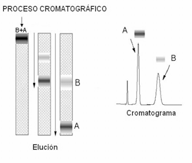
En todas las separaciones cromatográficas, la muestra se disuelve en una fase móvil, que en este caso (HPLC) es un líquido, y cuya única función es transportar el analito a través de la columna. Esta fase móvil se hace pasar a través de una fase estacionaria inmiscible, que es una fase líquida inmovilizada sobre una superficie de un sólido inerte, que se mantiene fija sobre una columna. Las dos fases se eligen de forma tal, que los componentes de la muestra se distribuyen de modo distinto entre la fase móvil y la estacionaria.
Aquellos analitos que son retenidos con mayor afinidad por la fase estacionaria se moverán lentamente a través de la columna, debido al flujo de la fase móvil; por el contrario, los analitos con poca afinidad con la fase estacionaria, se moverán con mayor rapidez.
Las características principales de esta técnica son su sensibilidad, su fácil adaptación a las determinaciones cuantitativas exactas, su idoneidad para la separación de especies no volátiles o termolábiles y su gran aplicabilidad.
Por otro lado, la cromatografía de gases (CG) es una técnica analítica dedicada a la separación, identificación y cuantificación de mezclas de sustancias volátiles y semivolátiles. Con esta técnica las mezclas son separadas en fase gaseosa, y sus límites de aplicabilidad están marcados fundamentalmente por la estabilidad térmica de los compuestos por separar. Por lo general, la utilización de la cromatografía de gases está restringida a la separación de compuestos con un peso molecular menor de 1000 daltones y a una temperatura máxima de trabajo de aproximadamente 400º C; dentro de estos límites, como ya se ha mencionado, la única limitación existente será la estabilidad térmica de la muestra.
Para realizar una separación mediante cromatografía de gases, se inyecta en una corriente de un gas inerte a elevada temperatura una pequeña cantidad de la muestra por separar; esta corriente de gas atraviesa una columna cromatográfica que separará los componentes de la mezcla por medio de un mecanismo de partición (cromatografía gas líquido), de adsorción (cromatografía gas sólido) o, en muchos casos, por medio de una mezcla de ambos. Los componentes separados emergerán de la columna a intervalos discretos y pasarán a través de algún sistema de detección adecuado, o bien serán dirigidos hacia un dispositivo de recolección de muestras.
Resonancia del plasmón de superficie - BIACORE
La introducción a principios de los años 90 de una nueva tecnología de biosensores basada en el fenómeno de resonancia de plasmón de superficie (SPR, del inglés surface plasmon resonance) ha permitido la visualización en tiempo real del proceso de interacción entre biomoléculas.
Uno de los instrumentos biosensores más empleados es el modelo Biacore desarrollado por BIACORE AB (Uppsala, Suecia). Se define como biosensor un instrumento que combina, por un lado, un mecanismo biológico y, por el otro, un transductor que genera una señal reconocible en respuesta al proceso biológico. El Biacore utiliza un biosensor basado en la resonancia del plasmón de superficie y el sistema es capaz de monitorizar de forma precisa y en tiempo real la interacción entre una especie unida a la superficie del sensor (ligando) y otra que circula en disolución (analito).
En los últimos años la técnica de SPR se ha utilizado para el estudio de una gran variedad de interacciones, entre las que destacan las interacciones antígeno-anticuerpo y las interacciones de biomoléculas con modelos de membrana, prueba de ello es el gran número de publicaciones aparecidas en los últimos años.
El sistema de detección de un instrumento de SPR está compuesto por un sistema óptico y por el chip sensor, en el cual tiene lugar el fenómeno de resonancia del plasmón de superficie y que está formado por un sustrato de vidrio en el que se deposita una lámina de oro de 50 nm de grosor sobre la cual se encuentra una matriz hidrófoba de 100 nm con un 2-3% de dextrano. Esta matriz constituye un medio compatible con las interacciones biomoleculares y permite la inmovilización de gran número de ligandos con bajos niveles de unión específica. El chip sensor forma parte de una unidad de microfluido por la cual circulan las disoluciones que interaccionarán con el ligando unido al chip. Este sistema de microfluido da lugar a cuatro celdas de flujo independientes sobre el chip sensor. Por el otro lado, el chip sensor está en contacto con el prisma del sistema óptico a través del cual se enfoca la luz cercana al infrarrojo y polarizada hacia el plano no modificado del chip sensor (figura 1). La luz reflejada se analiza en un detector de diodos fijo y bidimensional.
Figura 1.
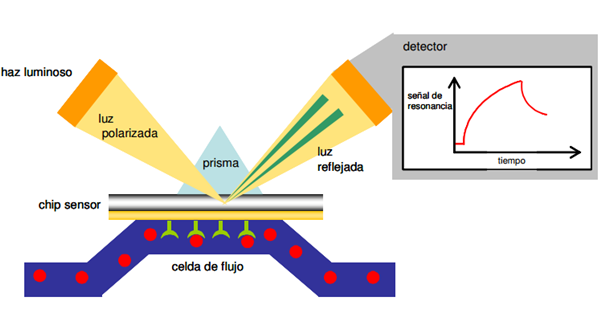 Fenómeno de la resonancia del Plasmón de superficie. La resonancia del plasmón de superficie se produce por una reflexión total del haz de luz incidente al interaccionar con los plasmones por lo que se observa una reducción de la intensidad de la luz reflejada.
Fenómeno de la resonancia del Plasmón de superficie. La resonancia del plasmón de superficie se produce por una reflexión total del haz de luz incidente al interaccionar con los plasmones por lo que se observa una reducción de la intensidad de la luz reflejada.
Tal y como se observa en la figura 1, el fenómeno de resonancia de plasmón de superficie se produce cuando un haz de luz ilumina la interfase entre dos medios (en este caso vidrio y disolución acuosa) con distinto índice de refracción, entre los que se ha insertado una capa fina de metal (en este caso oro). La onda evanescente creada por la reflexión total interna interacciona con los electrones oscilantes o plasmones del metal, causando una disminución en la intensidad de la luz reflejada. El ángulo de resonancia al que se da este fenómeno es sensible al índice de refracción de la solución próxima al metal. Como la longitud de onda de la luz incidente y el índice de refracción del vidrio y el oro se mantienen constantes, el ángulo de resonancia variará solamente con los cambios en el índice de refracción de la fase acuosa, y estos cambios serán debidos a variaciones en la masa al interaccionar las biomoléculas en este medio.
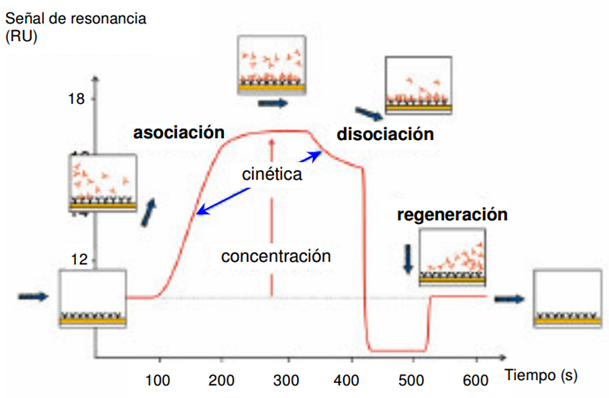
Cuando se representan las variaciones del ángulo de resonancia (en unidades de resonancia, RU) frente al tiempo se obtienen los sensorgramas. 1000 unidades de resonancia equivalen a un incremento de 0.1 grados del ángulo de resonancia de plasmón. Para una proteína promedio, este valor corresponde a una variación en la concentración en la superficie de 1 ng mm-2. En la figura 2 se muestra un sensorgrama típico de interacción entre biomoléculas con los cambios que se producen en el chip durante el proceso. En la superficie de dextrano del chip sensor se inmoviliza una de las moléculas o ligando y al inyectar el analito en la celda de microflujo se produce la interacción entre ambos, lo que da lugar a un aumento de la señal. La disociación empieza cuando se sustituye el ligando en circulación por el buffer de flujo. Finalmente, se inyecta una solución regeneradora que elimina de la superficie el analito no unido covalentemente y el sensorgrama revierte a la línea de base inicial.
Figura 2. Sensorgrama esquemático de la interacción entre moléculas.
Entre las aplicaciones de la técnica de SPR destacan el estudio de identificación de epítopos, la determinación de patrones de interacción en la búsqueda de nuevas moléculas farmacológicamente activas, la determinación de constantes cinéticas de interacción entre biomoléculas, y más recientemente, los estudios conformacionales y de interacción con modelos de membrana.
La utilización de la tecnología de biosensores para el análisis de la interacción antígeno-anticuerpo ha dado lugar a un gran número de publicaciones en los últimos años en los que se examina la viabilidad de ésta en la detección de anticuerpos contra patógenos en fluidos biológicos. Comparada con ensayos serológicos convencionales, la técnica de SPR ha demostrado ser una valiosa herramienta de diagnóstico debido a que permite la detección en tiempo real y la monitorización de la interacción entre moléculas biológicamente activas sin necesidad de utilizar reactivos marcados, además de que permite que uno de los ligandos, inmovilizado en la superficie sensora, sea regenerado y reutilizado en múltiples análisis. Es importante subrayar, que al trabajar a flujos muy bajos, la técnica SPR se reduce considerablemente el volumen de muestra requerido para el análisis, a la vez que se precisa de tiempos cortos.
Aplicaciones del BIACORE
El Biacore es capaz de monitorear casi cualquier interacción molecular mientras uno de los elementos que participan de la interacción pueda ser inmovilizado en la superficie de un chip.
| Interacciones entre proteínas | |
|---|---|
 |
|
.
| Moléculas pequeñas | |
|---|---|
 |
|
| Proteínas transmembranales | |
|---|---|
 |
|
| Ácidos nucleicos | |
|---|---|
 |
|
| Carbohidratos | |
|---|---|
 |
|
| Virus y células | |
|---|---|
 |
|
Equipos
| Manual de procedimientos para entrega de muestras (HPLC y CG-EM, RAI 2015)
System Manual (Agilent Technologies, Inc. 2010) |
Cromatógrafo HPLC 1260 Infinity Bio-inert Quaternary con detector de arreglo de diodos |
| Manual de procedimientos para entrega de muestras (HPLC y CG-EM, RAI 2015)
Manual de funcionamiento del CG 7890B (Agilent Technologies, Inc. 2013) Manual de funcionamiento del EM 5977A (Agilent Technologies, Inc. 2012) |
Cromatógrafo de gases Agilent 7890B acoplado al espectrómetro de masas Agilent 5977A |
| Manual de funcionamiento del Biacore T200 (RAI 2015) | Biacore T200 GE |
|
Equipo con analizador de masas híbrido Q-TOF (Cuadrupolo-Tiempo de Vuelo). Es posible realizar la exploración cualitativa y cuantitativa del proteoma de muestras complejas (e.g. lisados celulares) a alta resolución. |
AB Sciex TripleTOF 5600+ |
Otros equipos: manuales y guías rápidas del usuario
| Guía rápida ChemiDoc MP
Manual del ChemiDoc MP Guía rápida xMARK Manual del espectrofotómetro xMARK Manual del Bioplex 200 |
Contacto
Para mayor información o asesoría sobre los servicios favor de contactar a:
-
Dr. José Luis Maravillas Montero
Investigador Responsable (BIACORE)
- maravillascic.unam.mx
-
Dr. David Eduardo Meza Sánchez
Técnico Académico (BIACORE)
- dmezacic.unam.mx
-
Dr. Juan Manuel Germán Acacio
Investigador Responsable (Cromatografía)
- jmgacic.unam.mx
-
Dr. José Paez
Técnico Académico (Cromatografía)
- paezcic.unam.mx
- +01 (55) 5487 0900 Ext. 6333 ó 6334
-
M. en C. Hilda Sánchez Vidal
Técnica colaboradora (Cromatografía)
- hilda.sanchezvincmnsz.mx
- +01 (55) 5487 0900 Ext. 6328 ó 6338
